Son las grasas y aceites comestibles son esteres de ácidos grasos de cadena larga y gricerol los lípidos no se definen por su estructura si no por la técnica que se utiliza para separar sus miembros, la extracción de con disolventes.
los lípidos se se clasifican en:
LIPIDOS SAPONIFICABLES
LIPIDOS NO SAPONIFICABLES
LIPIDOS SAPONIFICABLES
Uno de los mas importantes ya que consiste de compuestos con uno o mas grupos que pueden hidrolizarse o saponificarse y en la mayoría de ejemplos son grupos éster y un gran número de familias se encuentra se encuentran en esta clase algunas de estas son las ceras, grasas neutras, fosfolípidos y glucolípidos.
LIPIDOS NO SAPONIFICABLES
Estos carecen de grupos que puedan hidrolizarse o saponificarse, entre ellos están incluidos el colesterol y muchas hormonas.
https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhbaaERI_i10kE-X3Ofd2N2Wjq0DbUXrP0RlsU27OP8tFkrYdoI_h1Gap0bkHJZ5TVtulgQ9C4r3Z5kW7xao2VjaMZ-yIobY3T6NV6RRjWoguJCpHLaQMYrB_3RHp36emEABnjfOnLTvWVt/s1600-h/lipidos,+mapa+conceptual.jpg
ÁCIDOS NUCLEICOS
Los ácidos nucleicos (AN) fueron descubiertos por Freidrich Miescher en 1869.
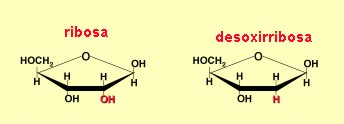
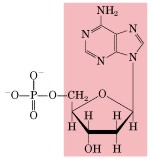
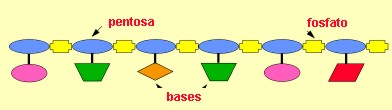
En la naturaleza existen solo dos tipos de ácidos nucleicos: El ADN (ácido desoxirribonucleico) y el ARN (ácido ribonucleico) y están presentes en todas las células. Su función biológica no quedó plenamente confirmada hasta que Avery y sus colaboradores demostraron en 1944 que el ADN era la molécula portadora de la información genética. Los ácidos nucleicos tienen al menos dos funciones: trasmitir las características hereditarias de una generación a la siguiente y dirigir la síntesis de proteínas específicas. Tanto la molécula de ARN como la molécula de ADN tienen una estructura de forma helicoidal. Químicamente, estos ácidos están formados, como dijimos, por unidades llamadas nucleótidos: cada nucleótido a su vez, está formado por tres tipos de compuestos: 1. Una pentosa o azúcar de cinco carbonos: se conocen dos tipos de pentosas que forman parte de los nucleótidos, la ribosa y la desoxirribosa, esta última se diferencia de la primera por que le falta un oxígeno y de allí su nombre. El ADN sólo tiene desoxirribosa y el ARN tiene sólo ribosa, y de la pentosa que llevan se ha derivado su nombre, ácido desoxirribonucleico y ácido ribonucleico, respectivamente.
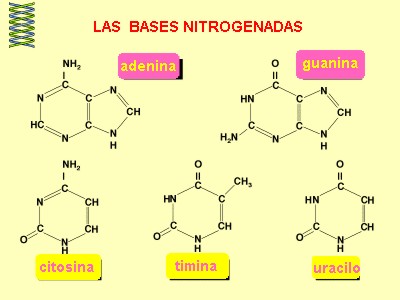
2. Una base nitrogenada: que son compuestos anillados que contienen nitrógeno. Se pueden identificar cinco de ellas: adenina, guanina, citosina, uracilo y timina.
3. Un radical fosfato: es derivado del ácido fosfórico (H3PO4-).
La secuencia de los nucleótidos determina el código de cada ácido nucleico particular. A su vez, este código indica a la célula cómo reproducir un duplicado de sí misma o las proteínas que necesita para su supervivencia.
El ADN y el ARN se diferencian porque: - el peso molecular del ADN es generalmente mayor que el del ARN - el azúcar del ARN es ribosa, y el del ADN es desoxirribosa - el ARN contiene la base nitrogenada uracilo, mientras que el ADN presenta timina La configuración espacial del ADN es la de un doble helicoide, mientras que el ARN es un polinucleótido lineal, que ocasionalmente puede presentar apareamientos intracatenarios Ácido Desoxirribonucleico (ADN) El Ácido Desoxirribonucleico o ADN (en inglés DNA) contiene la información genética de todos los seres vivos.
Cada especie viviente tiene su propio ADN y en los humanos es esta cadena la que determina las características individuales, desde el color de los ojos y el talento musical hasta la propensión a determinadas enfermedades. Es como el código de barra de todos los organismos vivos que existen en la tierra, que está formado por segmentos llamados genes. La combinación de genes es específica para cada organismo y permite individualizarnos.Estos genes provienen de la herencia de nuestros padres y por ello se utiliza los tests de ADN para determinar el parentesco de alguna persona. Además, se utiliza el ADN para identificar a sospechosos en crímenes (siempre y cuando se cuente con una muestra que los relacione). Actualmente se ha determinado la composición del genoma humano que permite identificar y hacer terapias para las enfermedades que se trasmiten genéticamente como: enanismo, albinismo, hemofilia, daltonismo, sordera, fibrosis quística, etc. Agentes mutagénicos y las diferentes alteraciones que pueden producir en el ADN
Las mutaciones pueden surgir de forma espontánea (mutaciones naturales) o ser inducidas de manera artificial (mutaciones inducidas) mediante radiaciones y determinadas sustancias químicas a las que llamamos agentes mutágenos. Estos agentes aumentan significativamente la frecuencia normal de mutación. Así pues, distinguimos: 1) Radiaciones, que, según sus efectos, pueden ser: a) No ionizantes, como los rayos ultravioleta (UV) que son muy absorbidas por el ADN y favorecen la formación de enlaces covalentes entre pirimidinas contiguas (dímeros de timina, por ejemplo) y la aparición de formas tautómeras que originan mutaciones génicas. b) Ionizantes, como los rayos X y los rayos gamma, que son mucho más energéticos que los UV; pueden originar formas tautoméricas, romper los anillos de las bases nitrogenadas o los enlaces fosfodiéster con la correspondiente rotura del ADN y, por consiguiente, de los cromosomas. 2) Sustancias químicas que reaccionan con el ADN y que pueden provocar las alteraciones siguientes: a) Modificación de bases nitrogenadas. Así, el HNO2 las desamina, la hidroxilamina les adiciona grupos hidroxilo, el gas mostaza añade grupos metilo, etilo, ... b) Sustitución de una base por otra análoga. Esto provoca emparejamientos entre bases distintas de las complementarias. c) Intercalación de moléculas. Se trata de moléculas parecidas a un par de bases enlazadas, capaces de alojarse entre los pares de bases del ADN. Cuando se produce la duplicación pueden surgir inserciones o deleciones de un par de bases con el correspondiente desplazamiento en la pauta de lectura. Ácido Ribonucleico (ARN): El “ayudante” del ADN Ácido nucleico formado por nucleótidos en los que el azúcar es ribosa, y las bases nitrogenadas son adenina, uracilo, citosina y guanina. Actúa como intermediario y complemento de las instrucciones genéticas codificadas en el ADN. La información genética está, de alguna manera, escrita en la molécula del ADN, por ello se le conoce como “material genético”. Por esto, junto con el ácido ribonucleico (ARN) son indispensables para los seres vivos. El ARN hace de ayudante del ADN en la utilización de esta información. Por eso en una célula eucariótica (que contiene membrana nuclear) al ADN se lo encuentra sólo en el núcleo, ya sea formando a los genes, en cambio, al ARN se lo puede encontrar tanto en el núcleo como en el citoplasma. | ||||||||||||||||||
| http://www.profesorenlinea.cl/Ciencias/AcidosNucleicos.htm | ||||||||||||||||||




![K=\frac{[C]^c[D]^d}{[A]^a[B]^b}](http://upload.wikimedia.org/math/c/3/7/c37c055a41f1d4c179787ca8522117dd.png)



 (también: π
(también: π 